-
코로나19 치료제 후보 물질을 연구 개발하고 있는 아주대학교 연구팀이 코로나19 바이러스 억제에 효과를 보이는 항바이러스 약물을 조사해 그 결과를 발표했다. 아주대 최상돈 교수(생명과학과·대학원 분자과학기술학과, 사진)와 김문석 교수(응용화학생명공학과·대학원 분자과학기술학과), ㈜에스앤케이테라퓨틱스 공동 연구팀은 미국식품의약국(FDA)이 승인한 항바이러스제를 조사해 그 중 렘데시비르(Remdesivir)와 레디파스비르(Ledipasvir)가 코로나19에 항바이러스 작용이 있음을 입증해냈다고 밝혔다. ㈜에스앤케이테라퓨틱스는 최상돈 아주대 교수가 설립한 희귀 면역 질환 치료제 개발사다.해당 내용은 ‘FDA 승인 항바이러스 약물 중 Remdesivir와 Ledipasvir의 SARS-CoV-2 증식 억제 작용(Remdesivir and Ledipasvir among the FDA-Approved Antiviral Drugs Have Potential to Inhibit SARS-CoV-2 Replication)’이라는 논문으로 국제 저널 <셀즈(Cells)>에 지난 4월 게재됐다. 코로나19 바이러스는 RNA 바이러스 중에서도 비교적 큰 바이러스게놈을 갖는 양성 가닥 RNA 바이러스다. 게놈(genome)은 개체의 모든 유전자와 유전자가 아닌 부문을 모두 포함한 염기서열로, 한 생물종의 완전한 유전 정보의 총합이다. 코로나19 바이러스의 게놈 RNA는 뉴클리오캡시드 단백질로 커버되어 있고, 폴리아데닐화(polyadenylation)되어 있으며, 외피에 스파이크(spike) 당단백질을 갖는다. 현재 개발된 코로나19 백신들은 모두 이 스파이크 당단백질을 타깃으로 하고 있다.아주대 연구팀은 신종 코로나 바이러스(SARS-CoV-2)가 숙주 세포 에 들어가 바이러스 게놈의 전사 및 복제에 중요한 역할을 하는 RNA 의존성 RNA 중합 효소(RdRp; RNA-dependent RNA polymerase) 복합체의 억제 물질 개발을 진행 중이다. RNA 의존성 RNA 중합 효소(RdRp)는 변형되는 확률이 매우 낮아서 RNA 바이러스 복제를 제어하기 위한 가장 적합한 표적 중 하나다.연구팀은 우선 전 세계적인 코로나19의 급속한 확산과 사망자 수 증가에 최대한 신속하게 대응하기 위해 미국식품의약국(FDA)이 승인한 항바이러스제 가운데, 코로나19 바이러스 활성을 조사했다.아주대·㈜에스앤케이테라퓨틱스 연구팀은 컴퓨터 가상 스크리닝을 통해 미국식품의약국(FDA)이 승인한 수백 개의 항바이러스 약물을 우선 인실리코(in silico) 스크리닝 했다. 인실리코 스크리닝은 컴퓨터 또는 컴퓨터 시뮬레이션을 통해 수행되는 탐색기술이다. 연구팀은 약물과 RdRp의 분자역학 시뮬레이션을 거쳐 가능성 있는 약물을 1차 선별하고 베로 E6(Vero E6) 세포에서 코로나 바이러스(SARS-CoV-2)에 대한 약물의 항바이러스 활성을 평가했다. 그 결과 렘데시비르(Remdesivir)와 레디파스비르(Ledipasvir)가 코로나 바이러스에 항바이러스 작용을 함을 입증해 낸 것. 베로 E6세포는 1962년 아프리카 녹색원숭이 신장의 상피세포에서 분리 및 개발된 세포주로, 바이러스 감염 연구에 활용되고 있다. 조류인플루엔자 바이러스 백신, 로타바이러스 백신, 폴리오 백신, 공수병 백신 등이 베로 세포를 이용하여 생산되고 있다.최상돈 교수는 “코로나 바이러스는 주기적으로 변종이 나오고 있어 문제”라며 “장기적으로 코로나 바이러스 증식 자체를 억제하는 약물의 개발이 필요하다”고 진단했다. 최 교수는 이어 “이번 연구를 통해 코로나19의 치료에 있어, 직접 작용하는 약물을 단독으로 혹은 조합하여 사용할 수 있음을 알게 되었다는 데 의의가 있다”라고 덧붙였다. 코로나 바이러스(SARS-CoV-2)에 대한 약물 후보의 항 바이러스 활성 평가. (a-c) 오른쪽 세로축은 세포 생존력을 나타내고 왼쪽 세로축은 SARS-CoV-2에 대한 항 바이러스 활성을 나타냄.
-
57
- 작성자서정원
- 작성일2021-06-21
- 4649
- 동영상동영상
-
서형탁 교수 연구팀이 수소 연료 생산을 위한 물 분해 광전극을 단일 소재를 이용해 개발하는 데 성공했다. 무공해 방식으로 수소 연료를 생산할 수 있는 저비용 고효율 광전극으로 활용될 수 있을 것으로 보인다. 서형탁 교수(신소재공학과·대학원 에너지시스템학과, 사진 오른쪽)는 단일 소재 기반의 고효율 태양광 물 분해 신소재 광전극을 개발했다고 밝혔다. 관련 내용은 ‘이상적인 도핑과 일함수 조절을 통한 {002}면으로 정렬된 1차원 텅스텐 산화물의 태양광 물 분해 개선 효과(Enhanced solar water splitting of an ideally doped and work function tuned {002} oriented one-dimensional WO3 with nanoscale surface charge mapping insights)’라는 논문으로 촉매 분야 국제 학술지 <어플라이드 카탈리시스 B: 인바이런멘탈’(Applied Catalysis B: Environmental), IF=16.683> 5월6일자 온라인판에 게재됐다. 우리 학교 칼라누르 샨카라(Shankara Kalanur) 교수(신소재공학과, 사진 왼쪽)가 제1저자로 함께 참여했다.수소는 연료로 사용된 후 물이 배출되는 대표적인 청정 연료원으로, 최근 차세대 에너지 연료원으로 주목받으며 산업 전반에서 활용 영역을 확장하고 있다. 연료로서의 수소를 생산하기 위해서는 화석 연료를 개질(reforming)하는 방식이 주로 사용되고 있는데, 이 과정에서 수소 생산 중량의 9배가 넘는 이산화탄소(CO2)도 같이 배출된다. 때문에 대표적 온실가스인 이산화탄소 같은 공해 물질의 배출을 줄이기 위해 전기나 태양광을 이용하는 광·전기 화학적 물 분해 기술에 대한 연구가 최근 활발히 이루어지고 있다. 태양광이 반도체 광전극에 입사할 때 생성된 전하를 이용하여 물을 분해하는 방식으로, 이 방법은 이산화탄소 배출이 없는 청정 수소 생산 방식이다. 그러나 기존 화석연료 개질 방식에 비해 매우 낮은 생산 효율이 그동안 한계점으로 인식되어 왔다. 이러한 낮은 생산 효율을 극복하기 위해서는 태양광 물 분해 시스템에서 가장 핵심적인 역할을 하는 광전극의 광 반응 특성을 향상 시키고, 장기 반응 내구성을 확보하는 것이 관건이다. 최근 단일 소재 광전극으로는 이러한 기술적 향상을 이루는 데 한계가 있는 것으로 판명되어, 여러 소재를 적층하여 광전극을 형성하는 ‘탠덤’ 구조에 대한 연구가 많이 이루어져 왔다. 그러나 탠덤 구조를 이용하는 경우 공정이 복잡해져 광전극의 특성 재현성이 현저히 낮아지고 이종 소재 간 화학적 불안정성을 보이기도 하는 등 여러 문제가 발생해 왔다. 서형탁 교수팀은 기존에 널리 연구되어 왔으나 효율 향상 한계에 봉착했던 텅스텐 산화물(WO3) 광전극에 주목했다. 서 교수팀은 다른 소재를 추가한 이종 적층 구조를 쓰지 않고 단일 소재에 소량(1.14%)의 이트리움(Y)을 ‘도핑’할 경우 1차원 텅스텐 산화물 나노로드의 결정 방향이 광화학적으로 활성이 높은 {002}면에 대하여 정렬된다는 점을 발견해 냈다. 연구진은 최적 도핑 농도 및 공정 확보를 위해 수십 가지 경우의 불순물 농도를 검증, 최적 조건을 찾아냈다. 연구팀은 최적 조건으로 이트리움(Y)이 도핑된 텅스텐 산화물(WO3)에서 광전류가 200% 가량 대폭 향상되며, 촉매에 흡수된 빛에 의한 광전류의 수소 전환 효율은 95%에 이른다는 점을 확인했다. 그 밖에도 극소량의 도핑으로도 저항 감소, 전자구조 변화, 표면일함수 변화 등 다양한 물리·화학적 특성이 달라질 수 있음을 확인했다. 서형탁 교수는 “저가의 텅스텐 산화물에 극소량의 불순물 도핑을 통해 고효율 단일소재 기반의 나노구조 광전극 제조에 성공한 사례”라며 “이를 통해 최고 수준의 전환 효율로 수소를 생산할 수 있음을 확인했고, 앞으로 안정성을 더욱 개선해 실용화를 목표로 연구를 이어 가겠다”고 말했다. 이번 연구는 과학기술정보통신부·한국연구재단 주관 기초연구지원사업(기본)의 지원과 해외우수신진인력지원사업의 지원으로 수행됐다.
-
55
- 작성자서정원
- 작성일2021-06-16
- 4685
- 동영상동영상
-
아주대와 팬옵틱스 공동 연구팀이 실크 단백질 나노섬유를 활용해 다기능 전자문신을 구현하는 데 성공했다. 이에 원하는 회로를 그려 넣은 후 굴곡진 피부 조직에 부착, 진단 및 약물 전달용으로 활용할 수 있는 차세대 헬스케어 소자로 이용될 전망이다.우리 학교 김성환 교수(물리학과·대학원 에너지시스템학과, 사진 왼쪽)는 실크 단백질 나노섬유 위에 탄소나노섬유 잉크로 회로를 그려 넣는 방식의 전자문신 구현에 성공했다고 밝혔다. 이번 연구 성과는 신소재 분야 최고 권위지 중 하나인 <어드밴스드 머트리얼즈(Advanced Materials)> 권두 표지논문(Frontispiece)으로 5월6일 자에 온라인 게재됐다. 논문 제목은 ‘피부 위 진단 및 치료응용을 위한 다기능, 극박 전자문신(Multifunctional and Ultrathin Electronic Tattoo for On-Skin Diagnostic and Therapeutic Applications)’이다. 이번 연구는 광학 전문 기업 팬옵틱스와의 산학협력 연구를 통해 진행됐다. 제1저자로 우리 학교 나렌다 고굴라 BK연구 조교수(사진 오른쪽), 공동저자로 팬옵틱스의 김장선 대표이사 외 3인이 참여하였다. 최근 전 세계적으로 인체 조직에 부착 가능한 차세대 헬스케어용 전자 소자에 대한 연구가 매우 활발하다. 생체 신호를 직접 읽어 들이고 분석할 수 있는 덕분. 이러한 헬스케어용 전자 소자를 구현하기 위해서는 실제 생체 조직과 같이 유연하고 잘 늘어나는 전자 소자가 필요하다. 이에 많은 연구자들이 유연 기판에 전극과 전자 소자를 집적, 다양한 인체 신호를 읽고 분석하는 소자를 개발해왔다. 이러한 형태의 소자는 ‘피부를 인공적으로 모방한 전자 소자’라는 개념으로 해석되어 ‘전자 피부’라 불린다.이렇게 개발된 전자 피부와 실제 인체 피부와의 완벽한 인터페이스를 위해서는 지문을 비롯한 굴곡진 표면을 따라 부착할 수 있어야 하며, 생체 적합성도 중요하게 고려해야 한다. 따라서 전자 회로를 생체적합 물질을 사용해 매우 얇게 구현해야 하는 어려움이 존재해왔다. 이에 김성환 교수 공동 연구팀은 천연 실크 단백질에 주목했다. 누에고치에서 나온 실크 단백질은 생체친화적이고 물리적·화학적 물성이 우수해 활용 가능성이 높은 바이오 고분자 소재다.먼저 연구진은 전기방사 방법을 활용하여 인간 머리카락 50분의 1 두께의 실크 나노섬유 종이를 제작했다. 여기에 탄소 나노섬유 잉크를 활용, 붓으로 실크 나노섬유 종이에 원하는 모양의 회로를 그려 넣었다. 잉크가 마르면서 그린 모양대로 회로가 떨어져 나오고, 이를 문신 스티커처럼 물을 살짝 묻힌 피부에 올려놓기만 하면 전자문신을 형성하는 것이 가능하다. 이렇게 만든 전자문신은 두께가 매우 얇아서 지문처럼 촘촘하게 주름진 표면에도 올릴 수 있으며, 샤워를 제외한 여타 일상 생활 속에서도 안정적으로 전기적 특성을 유지할 수 있다. 전자문신의 사용을 마치면 물티슈 등으로 가볍게 닦아내면 되기에 관리도 쉽다. 탄소 나노섬유에서 기인할 수 있는 유해성은 전자문신 중간에 삽입된 실크 나노섬유가 차단해 준다. 피부에 부착한 전자문신은 심전도와 근전도 검사를 위한 전극으로, 혹은 온열 치료나 약물 전달을 위한 패치로 응용이 가능하다. 전자문신에 약한 전류를 흘려주거나 빛을 쬐어주면 탄소 나노섬유에 의해 열을 발생시킬 수 있다. 특히 빛을 활용할 수 있다는 점은 원격으로 전자문신을 데울 수 있음을 의미하고, 이는 응용 범위가 매우 넓다는 것으로 해석할 수 있다. 실크 단백질에 원하는 약물을 탑재할 수도 있어, 원격으로 문신 온도를 조절하여 약물 전달 효율을 조율할 수 있다. 김성환 교수는 “인체 피부에 전자회로를 집적하려는 연구는 많은 진전을 이루어 왔지만 생체 적합성 및 생체 조직과의 인터페이스 문제는 상대적으로 간과되어 온 측면이 있다”며 “생체 물질인 단백질을 활용해 생체 조직과 전자 소자의 상이한 물성 차이를 극복할 인터페이스를 제공할 수 있다”고 말했다.김 교수는 이어 “이번에 개발한 소재 기술은 바이오 소재들이 전자 소자 구현에도 적용될 수 있음을 보여줬다는 데 의의가 있다”며 “앞으로 다양한 헬스케어 소자와 소프트 로보틱스 분야에 적용할 수 있을 것”이라고 덧붙였다. 이번 연구는 한국연구재단 주관 중견연구자지원사업, BK21 Four 사업과 경기도 주관 지역협력연구센터사업(GRRC), 한국에너지기술평가원 주관 에너지인력양성 사업의 지원으로 수행되었다. 관련 기술은 팬옵틱스와의 산학협력 연구를 통해 개발되었으며, 국내 특허 출원과 함께 일부 기술이전 되었다. <연구 개념을 보여주는 모식도. 누에고치로부터 만들어진 실크 종이에 전도성 잉크로 전자회로를 그린 후 문신처럼 피부에 부착할 수 있다>
-
53
- 작성자서정원
- 작성일2021-06-14
- 4909
- 동영상동영상
-
-
51
- 작성자서정원
- 작성일2021-03-10
- 5865
- 동영상동영상
-
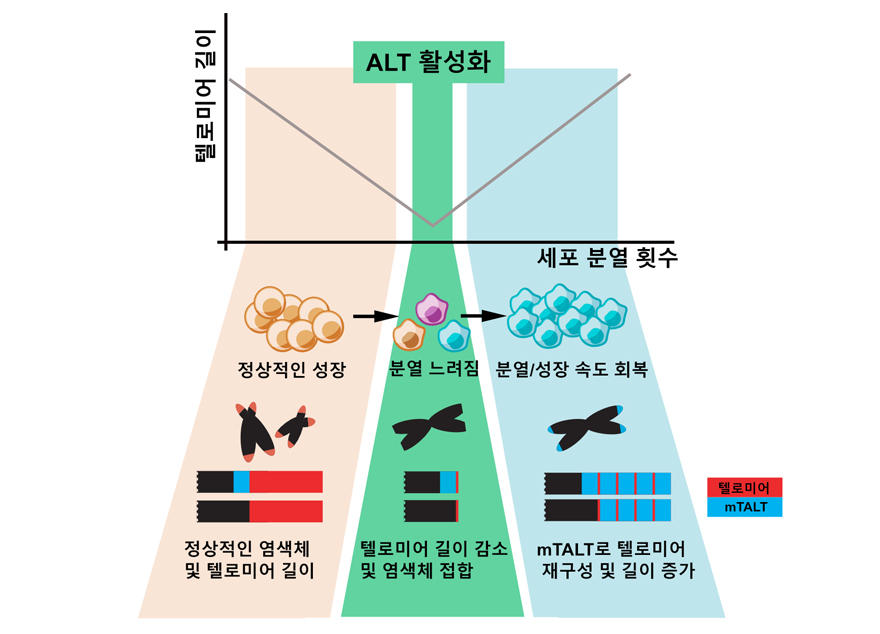
아주대학교와 서울대학교 공동 연구팀이 세포 노화 타이머를 제어할 수 있는 새로운 방법을 발견했다. ‘세포 분열의 타이머’로도 불리는 텔로미어가 새롭게 재구성된 사례를 발견한 것으로, 세포 노화의 비밀을 푸는 단서가 될 것으로 보인다. 아주대 박대찬 교수(생명과학과·대학원 분자과학기술학과)와 서울대 이준호 교수가 교신저자로 함께 한 이번 연구는 자연과학 분야 세계적 학술지인 <네이처 커뮤니케이션즈(Nature Communications, IF=12.121)> 2월17일자에 게재되었다. 우리 학교 대학원 분자과학기술학과 김다은 학생이 공동저자로 참여했다. 논문 제목은 ‘배아줄기세포에서 텔로미어 서열이 아닌 서열로 만들어진 텔로미어(Telomeres reforged with non-telomeric sequences in mouse embryonic stem cells)’이다. 우리 몸을 구성하는 세포는 분열하고 증식하며 생명 현상을 유지한다. 그러나 세포는 무한히 분열할 수 없으며 분열 과정에서 일정 부분의 유전 정보가 사라지도록 설계되어 있다. 텔로미어는 염색체 말단의 보호 구조로, 세포 분열 시 유전 정보를 대신해 사라지는 보호막 역할을 수행한다. 텔로미어의 길이가 일정 수준 이하로 짧아지면 세포는 분열을 멈추는 세포 노화 상태로 들어간다. 그러나 생식 세포나 줄기 세포, 암세포처럼 활발히 분열하는 세포는 ‘텔로머레이즈’라는 효소를 사용해 텔로미어의 길이를 유지하고 무한한 분열 능력을 가진다. 따라서 세포들이 정상적인 기능을 할 수 있도록 텔로미어의 길이와 분열 수를 조절하는 것이 중요하다. 특히, 텔로미어 유지 기전에 대한 정확한 이해는 부작용 없는 항암 전략, 노화 지연 등을 위한 이론적 기반이 된다. 일부 암세포에서는 ‘대안적인 텔로미어 유지기전(ALT, Alternative Lengthening of Telomeres)’이라는, 텔로머레이즈 효소를 활용하지 않고 텔로미어를 유지할 수 있는 기전이 발견되었다. 그런데 인간 암세포의 경우, ALT를 사용하더라도 일반적인 반복서열을 지닌 텔로미어의 사례만 보고되어 있었다. 연구팀은 이러한 일반적인 반복서열을 보이는 텔로미어가 아닌 다른 구성을 가지는 형태로 재구성된 사례를 포유류 모델 최초로 확인하는 데 성공했다. 텔로머레이즈가 불활성화된 생쥐 배아줄기 세포 배양 중 아주 일부의 세포에서 ALT가 활성화되어 정상적인 분열 속도를 회복한 것. 이때의 ALT 세포는 단순반복 서열이 아닌 독특한 서열이 증폭된 구조를 보였다. 박대찬 교수 연구팀은 이를 ‘mTALT (mouse template for ALT)’라고 명명했으며, 이를 통해 인간 암세포에도 또 다른 형태의 텔로미어가 존재할 가능성을 찾아냈다. 또한, 연구팀은 ALT가 실제 작동하는 과정을 추적하기 위해 텔로미어 길이가 정상적인 세포, 노화 상태에 있는 세포, ALT가 활성화된 이후의 세포 등 다양한 시점의 생쥐 배아줄기 세포에 유전체, 전사체, 단일세포 전사체, 단백질체 분석 등 다양한 오믹스 기법을 활용했다. 이를 통해 ALT 세포의 분자적인 특징을 규명하는 데 성공했다. 연구팀은 "이번 연구를 통해 인간 암 세포에서 또 다른 형태의 텔로미어가 존재할 가능성이 드러났다“며 ”텔로미어라는 개념이 염색체 끝 부분의 반복서열구조와 텔로머레이즈 효소로 이루어진 단순 공식이 아니라 염색체 끝을 보호하는 다양한 기전을 총칭하는 말로 확장되는 데 기여하게 됐다"고 밝혔다. 이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 신진연구자지원사업, 중견연구자지원사업 지원으로 수행되었다.세포 분열에 의한 텔로미어의 변화와 ALT 기전 활성화 설명 모델
-
49
- 작성자서정원
- 작성일2021-03-02
- 6965
- 동영상동영상